Le projet Artemis
En savoir plus...
Résultats mitigés pour ARTEMIS,
le projet de recherche préclinique
soutenu par ARAMISE
ARTEMIS, le projet de recherche soutenu en 2018 et 2019 par ARAMISE est parvenu à son terme.
Le Pr Wassilios Meissner qui a piloté cette étude en a communiqué les résultats au cours de l’assemblée générale d’Aramise, en mai 2020 :
- les deux molécules, belnacasan et anle138b, ont confirmé, chacune, administrée seule, leur capacité à lutter contre les agrégats d’alphasynucléine en cause dans l’AMS.
- leur association dans le traitement de souris AMS n’a pas amélioré leur efficacité.
- cette étude a permis de confirmer l’intérêt de l’anle138b et de renforcer l’intérêt pour le belnacasan, en sommeil dans un laboratoire américain.
« Les deux molécules, belnacasan et anle 138b, ont individuellement permis de diminuer l’accumulation de l’alpha-synucléine et de préserver les neurones. (…) ». indique le Pr Meissner, « Ces expériences nous ont permis de confirmer les effets bénéfiques de l’anle 138b et du belnacasan sur la préservation des neurones et l’accumulation de l’alpha-synucléine.»
Cependant, l’association des deux molécules n’a pas apporté d’effet supplémentaire. En parallèle, nous avons démontré dans le modèle de la souris AMS que le belnacasan réduit l’activité de la caspase-1* qui est sa cible thérapeutique. »
* la caspase 1 est une enzyme qui favorise l’agrégation pathologique des protéines alpha-synucléines
Quelles suites pour ces recherches et quel avenir pour ces molécules ?
Au terme d’un essai de phase 1 concluant mené par le laboratoire MODAG créateur de la molécule, l’anle138b va être testée fin 2020 chez des malades souffrant de la maladie de Parkinson. Le travail mené à Bordeaux a permis de confirmer l’efficacité de la molécule dans le modèle animal et l’intérêt d’en poursuivre le développement dans les synucléinopathies.
Concernant le belnacasan, actuellement propriété du petit laboratoire américain Axovant, l’avenir est moins immédiat. Belnacasan présente l’inconvénient de franchir difficilement la barrière hémato-méningée et de ne s’accumuler que faiblement dans le cerveau. La molécule a toutefois démontré une efficacité réelle sur l’activité de la caspase1, une enzyme qui provoque la coupure des protéines alphasynucléine ce qui favorise leur regroupement en agrégats. « Nous sommes en train de développer avec des partenaires aux Etats-Unis des molécules qui ressemblent par leur structure mais qui passent plus facilement la barrière hémato-méningée. Le développement est toujours d’actualité, mais aujourd’hui nous ne sommes pas encore à un stade où le laboratoire semble motivé pour se lancer dans l’aventure d’un essai thérapeutique. », indique le Pr Meissner.
Enfin, les chercheurs de Bordeaux entendent poursuivre la recherche de possibles différences d’effets des molécules testées : « Cela nous a échappé dans les analyses que nous avons réalisées jusqu’ici : nous souhaitons comparer dans quelle mesure le belnacasan, l’anle138b ou leur combinaison peuvent avoir des effets distincts sur des formes différentes d’alphasynucléine. C’est un travail en cours qui malheureusement a été retardé en raison du confinement mais que nous allons reprendre pour compléter la publication qui va suivre le travail soutenu par Aramise. »
Une coopération européenne contre l’alpha-synucléine
Pendant 4 ans, entre 2014 et 2017, les 5 partenaires, autrichiens, allemands et français, du consortium SYMPATH ont testé quatre molécules. Chacune ciblait l’alpha-synucléine via des mécanismes différents.
|
La première stratégie testée à Bordeaux visait à augmenter la dégradation de l’alpha-synucléine en renforçant l’un des mécanismes naturels d’élimination des protéines : l’autophagie. La rapamycine est une molécule qui a cette capacité de booster l’autophagie. Les souris AMS qui l’ont reçue pendant 12 semaines dans leur nourriture ont présenté une diminution de la densité d’inclusions oligodendrogliales dans la substance noire. Cependant, la protection des neurones s’est avérée partielle, sans retour à une fonction normale des neurones produisant de la dopamine par rapport un groupe de souris témoin. |
SYMPATH, c’est le nom du consortium soutenu entre 2014 et 2017 par l’Union européenne, via l’Agence nationale de la recherche pour l’équipe française. |
|
Deux autres molécules, belnacasan et anle138b, ont individuellement permis de diminuer l’accumulation de l’alphasynucléine et de préserver les neurones. C’est l’hypothèse d’une action plus efficace de la combinaison des deux molécules qui a été testée sur des souris AMS dans le cadre de la recherche pré-clinique ARTEMIS. Enfin, stratégie et molécules prometteuses, AFFITOPE PD01A et PD03A, des vaccins produits par AFFiRiS, une PME autrichienne spécialisée dans les stratégies d’immunothérapie notamment pour les maladies neurodégénératives, ont été testées chez des personnes atteintes d’AMS précoce. Les résultats de cette étude clinique menée sur un groupe d’une trentaine de malades ont été présentés début mars 2018 au congrès de New-York de l’AMS par le Pr Meissner. Ils ont montré l’innocuité des vaccins, ce qui était le but de cet essai clinique de phase 1, mais aussi une « réponse immunitaire claire pour le PD01A contre le peptide lui-même et la protéine alpha-synucléine ». Les études devront se poursuivre pour évaluer l’intensité et la durée de la réponse immunitaire ■ |
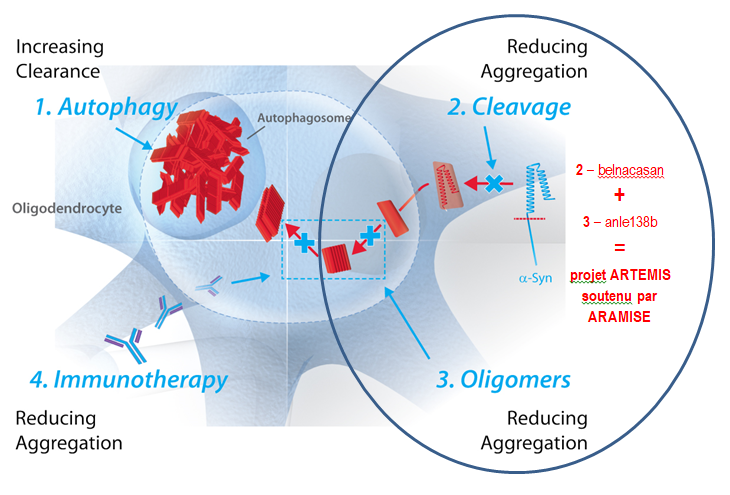
Illustration des effets des quatre stratégies complémentaires évaluées individuellement par le consortium ARTEMIS dans des modèles précliniques de l’AMS. 1) Stimulation de la dégradation intracellulaire de l’alpha-synucléine par rapamycine. |
Grâce à vos donsL’association ARAMISE a apporté, sur 2 ans, 40 000€ au projet ARTEMIS. Cette somme a contribué au financement du salaire du jeune chercheur, post-doctorant, en CDD pendant 10 mois à temps plein, qui a réalisé l’étude. |
Glossaire
Alpha-synucléine
Les dysfonctionnements de l’alpha-synucléine sont à l’origine de plusieurs pathologies appelées « synucléinopathies » : l’AMS, la maladie de Parkinson, la maladie à corps de Lewy.
L’alpha-synucléine est une petite protéine abondante dans le cerveau et nécessaire à son  fonctionnement.
fonctionnement.
Pour des raisons inconnues, cette protéine peut adopter une mauvaise conformation, jusqu’à former des agrégats. Ces agrégats vont encombrer les neurones, mais aussi, dans l’AMS, les oligodendrocytes, ces cellules de soutien des neurones. De plus, l’alpha-synucléine mal repliée propage de cellule en cellule son fonctionnement anormal. C’est pourquoi cette protéiné encore mal connue, ses différentes souches, son mode de propagation sont la principale cible des stratégies thérapeutiques visant l’AMS et les maladies voisines.
En savoir plus :
Voir la page "Au commencemen de la recherche, les cellules oligodendriales"
Voir la vidéo « l’alpha-synucléine dans l’AMS », par Pierre-Olivier Fernagut, coordonnateur du Conseil scientifique d’Aramise.
Dopamine
La dopamine est l'une des nombreuses substances chimiques qui servent de neurotransmetteurs dans le cerveau. La noradrénaline, l'adrénaline, la sérotonine et l'acétylcholine sont d'autres neurotransmetteurs. On a pu établir une relation entre le déficit en un neurotransmetteur spécifique et des troubles nerveux comme la maladie de Parkinson. La L-dopa (levodopa), prescrite dans le traitement de la maladie de Parkinson, est un précurseur direct de la dopamine qui passe la barrière hémato-encéphalique et peut être transformée en dopamine dans le cerveau.
80% des neurones 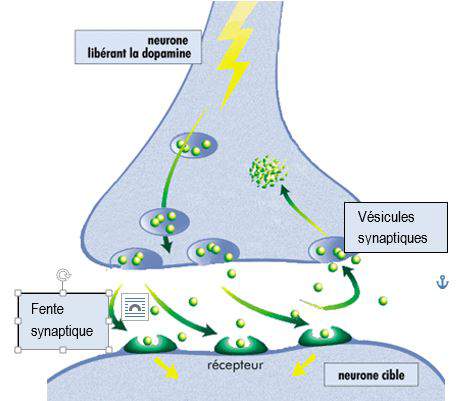 dopaminergiques contenus dans le cerveau sont situés dans la substance noire.
dopaminergiques contenus dans le cerveau sont situés dans la substance noire.
Synthétisée dans les terminaisons pré-synaptiques des neurones dopaminergiques, la dopamine est chargée dans des vésicules synaptiques qui la libèrent dans la fente synaptique à l’arrivée d’un potentiel d’action.
La dopamine libérée dans la fente est en partie captée par des récepteurs se trouvant sur la cellule postsynaptique et transmet ainsi le signal neuronal. Environ 80 % de la dopamine libérée est recaptée par les neurones dopaminergiques présynaptiques par des transporteurs sélectifs DAT (dopamine active transporter), qui contrôlent ainsi de façon précise la concentration dopaminergique, à la fois dans le temps et dans l’espace.
Voir aussi :
- voies dopaminergiques
- neurotransmetteur
- synapse
Immunothérapie
L’immunothérapie dans les synucléinopathies.
A) Pour des raisons encore mal élucidées, génétiques ou environnementales, un mauvais repliement de l’α-synucléine (en blanc l’α-synucléine normale, en jaune l’α-synucléine mal conformée) survient en intracellulaire et conduit à la formation d’agrégats oligomèriques (*) puis de fibrilles (**). Les agrégats peuvent être ensuite relargués en extracellulaire.
B) Les agrégats d’α-synucléine peuvent alors pénétrer dans de nouvelles cellules nerveuses, déclencher le mauvais repliement de l’α-synucléine normale de la cellule et provoquer la formation d’agrégats.
1) Via leur portion Fab (fragment antigen binding), les anticorps peuvent fixer les formes anormales d’α-synucléine afin de les neutraliser et/ou de favoriser leur dégradation.
2) Via leur portion Fc (fragment cristallisable), les anticorps peuvent se lier à des récepteurs situés à la surface des neurones et favoriser ainsi l‘élimination intracellulaire de l’α-synucléine, en particulier au niveau des lysosomes.
3) Les anticorps peuvent aussi se lier par leur portion Fab aux récepteurs qui permettent l’absorption des agrégats d’α-synucléine et ainsi empêcher leur internalisation.
4) Des intracorps peuvent être administrés via un plasmide et agir en intracellulaire où ils favorisent la dégradation des agrégats et/ou empêchent l’agrégation des monomères.
5) Les complexes anticorps–agrégats d’α-synucléine peuvent aussi se lier à des récepteurs présents à la surface de la microglie et déclencher leur phagocytose.
L’immunothérapie active, ou vaccination, consiste à administrer un antigène (ici l’α-synucléine anormale ou des fragments d’α-synucléine anormale), pour déclencher une production d’anticorps spécifique, par le système immunitaire (réponse humorale).
L’immunothérapie passive consiste en l’administration directe d’anticorps produits ex vivo, dirigés contre l’α-synucléine anormale ou des fragments de cette dernière
Source : Revue Neurologies
